Mein Name ist Nepenthes lowii und ich bin eine fleischfressende Kannenpflanze. Ich komme nur in wenigen tropischen Gebirgsregenwälder im Norden der Insel Borneo vor. Mein Speiseplan ist selbst für eine Kannenpflanze aussergewöhnlich.
Fleischfressende Pflanzen
Gerade einmal 800 fleischfressende Pflanzenarten gibt es auf der Welt (1, 8). Somit ist Karnivorie ein seltenes Phänomen im Pflanzenreich. Karnivore Pflanzen haben verschiedene Strategien entwickelt, um ihre Beute zu fangen. Eine davon ist die Umwandlung von Pflanzenteilen zu Fallen. Dazu gehören die sogenannten Kannenpflanzen. Die grösste und namensgebende Familie der Kannenpflanzen sind die Nepenthaceae, mit nur einer Gattung Nepenthes und aktuell 123 bekannten Arten (2).
Vorkommen
Kannenpflanzen kommen in tropischen Gebieten vor: Von der Ostküste Madagaskars, über die Seychellen, kleine Gebiete in Indien, Sri Lanka, kleinere und grössere westpazifische Inseln, die York-Halbinsel in Nordaustralien bis nach Neukaledonien (1, 2, 3). Der höchste Artenreichtum der Kannenpflanzen findet man aber auf den indonesischen Inselgruppen, insbesondere Sulawesi, Borneo, Sumatra, aber auch auf den Philippinen.
Nepenthes lowii ist endemisch in Borneo, das heisst, sie kommt nur auf der Insel Borneo vor. Viele Arten findet man ausschliesslich in höheren Lagen tropischer Gebirge. Dies trifft auch auf Nepenthes lowii zu, welche zwischen 1'800 und 2'600 m.ü.M. wächst.3, 4,11 Man kann sie dort in den Provinzen Sabah und Sarawak in den Gebirgen finden, unter anderem dem Mount Kinabalu, Gunung Trus Madi, Gunug Murud und Gunung Mulu. 11

Verbreitung der Gattung Nepenthes mit der ungefähren Anzahl Arten nach Ent A. et al. (2015).
Lebensweise
Wie für karnivore Pflanzen typisch, wachsen Kannenpflanzen häufig auf sauren und nährstoffarmen Böden. Sie bevorzugen offene, sonnige Stellen (1,3,4). Dies können Heidewälder, Torfböden oder auch Standorte auf Felsen, Klippen oder Bäumen sein. Weil diese Standorte nährstoffarm und teilweise schwer zu durchwurzeln sind, mussten sich die Kannenpflanzen anpassen. Die fehlenden Nährstoffe kompensieren sie, indem sie Beutetiere fangen und verdauen (3). Je älter eine Pflanze wird, desto mehr ernährt sie sich durch ihre Kanne (1). Bei verschiedenen Arten macht der Anteil fleischiger Nahrung bis zu 70% aus (14). Auch heruntergefallenes Laub wird verwertet, bei einigen Arten bis zu 35% (15).
Aussehen
Bei vielen Arten bilden die jungen Pflanzen am Boden Rosetten aus ei- bis kugelförmigen Kannen mit Flügeln aus. Erst später klettern sie in schlingenden Ranken an der umliegenden Vegetation hinauf. Einige Arten sind auch Aufsitzerpflanzen auf Bäumen oder Felsen, sogenannte Epiphyten, respektive Litophyten. An den kletternden Sprossachsen bilden die Pflanzen in der Luft hängende längliche und trichterförmige Kannen aus.

Links die Kannen mit der Form eines «bayerischen Bierkruges» am Boden von Nepenthes ampullaria und rechts die hängende längliche Kanne von Nepenthes gracilis. Beides häufige Arten, aufgenommen im Bako Nationalpark in Sarawak, Borneo. © GREEN BOOTS
Nepenthes lowii hat zwei Gesichter (Dimorphismus). Wächst sie noch am Boden, sind die zylondrisch geformten Fallen am Boden nur 10 cm hoch und 4 cm breit. Sobald Nepenthes lowii aber nach oben gewachsen ist, bildet sie die typischen hängenden Kannen aus. Diese weisen eine besonders skurrile Form auf, mit in der Mitte zusammengeschnürten Kannen (5). Diese haben eine sehr weite Kannenöffnung, werden bis zu 20 cm hoch und sind rund 10 cm breit (12). Die Innenseite der Kannen ist rot gefärbt und der Deckel ist weit nach hinten geklappt (5).

Links hängende Kannen von Nepenthes lowii aufgenommen am Berg Trus Madi in Sabah, Borneo (© Arlo Hinckley) und rechts eine Pflanze in blühendem Zustand aufgenommen am Berg Murud in Sarawak, Borneo (© Chien Lee).
Aufbau der Kannen
Die Kannen am Boden und in der Luft können bei gewissen Arten auf unterschiedliche Beutetiere spezialisiert sein, z.B. kriechende oder fliegende Tiere. Die Kannen sind komplexe, passive Fallgruben, um kleine Insekten oder sogar kleine Säugetiere und Amphibien zu fangen (1,3). Das Innere der Kannen weist spezifische Zonen mit unterschiedlicher Funktion auf.
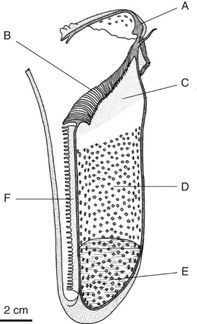
Längsschnitt durch eine typische fleischfressende Kannenpflanze nach Adlassnig et al. (2009). (A) Deckel der Kanne mit Nektardrüsen. (B) Glatter überhängender Rand um die Kannenöffnung. (C) Mit Wachs überzogene Rückhaltezone mit rutschigen Wänden. (D) Absorbationszone mit Sekretdrüsen. (E) Zone mit Verdauungsflüssigkeit. (F) Haarige länglich Anhängsel sogenannte Flügel.
A: Leicht abgesetzt am oberen Ende der Kanne befindet sich ein Deckel. Dieser ist fixiert und schliesst sich entgegen der Vermutung nicht zum Beutefang. Allerdings ist der Deckel häufig farbenprächtig und mit Nektardrüsen besetzt (1,3). Beides dient dazu, potenzielle Beutetiere anzuziehen. Bei vielen Arten hat der Deckel ausserdem die Funktion eines Regenschirmes und verhindert somit, dass die Flüssigkeit im Inneren der Kanne durch Regenwasser verdünnt wird (3).
B: Um den «Mund» herum bilden die Pflanzen einen Rand mit verhärtetem, glattem Gewebe, das sogenannte Peristom. Dieses erschwert eine Flucht aus der Kanne. Auch hier sitzen Nektardrüsen, bei gewissen Arten auch Duftsdrüsen (1). Diese locken die Beutetiere an.
C: Das Innere der Kanne ist mit Wachs überzogen und rutschig (3). Das Wachs hindert die Beutetiere daran zu fliehen und sorgt gleichzeitig dafür, dass diese nicht dauerhaft kleben bleiben (1).
D: Überhängende Drüsen sondern zusätzlich eine rutschige Substanz aus (3).
E: Das Beutetier fällt schliesslich in eine Flüssigkeit, in welcher sie ertrinken. Die wässrige bis zähflüssige Flüssigkeit entspringt Sekretdrüsen oder besteht aus gesammeltem Regenwasser, welches mit Säure, Verdauungsenzymen und Alkoholen angereichert ist (1,3,9). Je nach Art passt bis zu 1.5 Liter Flüssigkeit in die Kanne (9). Darin wird die Beute verdaut und in Aminosäuren und Zucker zersetzt, die die Pflanze anschliessend aufnimmt (1).
Spitzhörnchen-Toilette
Bei Nepenthes lowii ist die Unterseite des Deckels mit zahlreichen, bis zu 6 mm langen Borsten versehen. Diese produzieren ein gelatineartiges Sekret. Häufig wird dieses Sekret von Spitzhörnchen (Tupaia montana) abgeleckt, welches auf der Pflanze auch Schnecken jagt (5). Während die Spitzhörnchen die kohlenhydratreichen Sekrete essen, koten sie in die Kannen von Nepenthes lowii, was der Pflanze den Namen «Spitzhörnchen-Toilette» einbrachte. Dies kann bei Nepenthes lowii zwischen 57 bis 100% der Nährstoffaufnahme ausmachen und ist vermutlich eine Anpassung an die verringerte Dichte an Beutetieren, unter anderem Ameisen, in den tropischen Gebirgsregenwäldern (6). Der Mutualismus ist so ausgeprägt, dass bei den Kannen von Nepenthes lowii die Distanz von den Borsten, sprich der Nahrungsquelle der Spitzhörnchen, zum Rand der Kanne exakt der Körperlänge des Spitzhörnchens entspricht (7).

Links das Hochland-Spitzhörnchen, Tupaia montana, auf einer Nepenthes lowii, der sogenannten Spitzhörnchen-Toilette (© Chien Lee) und rechts die Borsten an der Unterseite des Deckels mit den kohlenhydratreichen Sekreten (© David Fefferman).
Mikrokosmus Kannenpflanze
Die Kanne selbst, bzw. die Flüssigkeit darin, kann auch aquatischer Lebensraum für erstaunlich viele spezialisierte Arten sein. Mikroben, Insektenlarven, ja sogar Krebstiere und Kaulquappen hat man schon in Kannenpflanzen entdeckt. In einer einzelnen Kannenpflanzenart konnten Forschende 59 vorkommende Arten nachweisen (9).
Selbst an Land lebende Tiere können in den Kannen leben. So sind sowohl eine Spinnen- als auch eine Ameisenart bekannt, welche in der Flüssigkeit von spezifischen Kannenpflanzen schwimmen können (1, 8). Einige Arten leben in der Kanne als Parasiten, die allermeisten aber als mutualistische Symbionten. So helfen sie beispielsweise beim Zerkleinern zu grosser Beutetiere oder transportieren überschüssige Beute ab, um Schäden an der Kanne oder die Verdünnung der Flüssigkeit zu verhindern (9).
Gefährdung
Von den 123 Arten der Kannenpflanzen gelten 37% als gefährdet, darunter auch Nepenthes lowii (2). Die grösste Gefahr für Kannenpflanzen ist die grossflächige Abholzung der Regenwälder, welche nebst der direkten Zerstörung von Arten und Lebensraum auch die Luftfeuchtigkeit und die Bodenbedingungen verändert (3). Des Weiteren kann der Klimawandel dazu führen, dass die benötigten klimatischen Bedingungen in wichtigen Regionen verschwinden (12). Einzelne Studien zeigen, dass Kannenpflanzen stark davon betroffen sein könnten. Auch für Nepenthes lowii könnten aufgrund des Klimawandels am Trus Madi, dem zweithöchsten Berg von Malaysia auf Borneo, nahezu 90% der Lebensräume verloren gehen (12).
Hilf mit, die tropischen Regenwälder in Borneo zu schützen! Und damit das Überleben dieser einzigartigen Kannenpflanzen zu sichern. Spende für unser Projekt in Gunung Niut.
Autor: Philipp Schmid
Literaturverzeichnis
(1) Moran J.A. & Clarke C.M. (2010) The carnivorous syndrome in Nepenthes pitcher plants, Plant Signaling & Behavior, 5:6, 644-648
(2) IUCN 2020. The IUCN Red List of Threatened Species. Version 2020-1. https://www.iucnredlist.org. Downloaded on 29 March 2020.
(3) Steiner H. (2002): Borneo: Ist Mountains and Lowlands with their Pitcher Plants. Trekking from 1992 to 2002 by Hugo Steiner. Toihaan Publishing Company, Kota Kinabalu, Sabah, Malaysia
(4) Kaul B. (1982): Floral and Fruit Morphology of Nepenthes lowii and N. villosa, Montane Carnivores of Borneo. American Journal of Botany, Vol. 69, No. 5, pp. 793-803
(5) Flora Malesiana, http://portal.cybertaxonomy.org/flora-malesiana/
(6) Clarke C.M. et al. (2009) Tree shrew lavatories: a novel nitrogen sequestration strategy in a tropical pitcher plant. Biology Letters 5: 632–635.
(7) Chin L.J. et al. (2010) Trap geometry in three giant montanepitcher plant species from Borneo is a function of tree shrew body size. New Phytologist 186: 461–470.
(8) Ingolf K. & Bauer U. (2020): Inside the trap: Biology and behavior of the pitcher‐dwelling crab spider, Misumenops nepenthicola. Plants, People, Planet. 2020;00:1–4.
(9) Adlassnig, W., Peroutka, M., & Lendl, T. (2011). Traps of carnivorous pitcher plants as a habitat: Composition of the fluid, biodiverity and mutualistic activities. Annals of Botany, 107, 181–194. https://doi.org/10.1093/aob/mcq238
(10) Ent A. et al. (2015) : Habitat differentiation of obligate ultramafic Nepenthes endemic to Mount Kinabalu and Mount Tambuyukon (Sabah, Malaysia). Plant Ecology. 216. 10.1007/s11258-015-0468-6.
(11) Clarke et al. (2000): Nepenthes lowii. The IUCN Red List of Threatened Species 2000: e.T39669A10250074. https://dx.doi.org/10.2305/IUCN.UK.2000.RLTS.T39669A10250074.en. Downloaded on 01 June 2020.
(12) Clarke, Charles (1997) "Nepenthes of Borneo", Natural History Publications, Kota Kinabalu
(13) Colin et al. (2011) : The potential impacts of climate change on the distribution of Nepenthes and Dipterocarps of the Trus Madi forest. Aberdeen Centre For Environmental Sustainability
(14) Schulze W. et al. (1997):The nitrogen supply from soils and insects during growth of the pitcher plants Nepenthes mirabilis, Cephalotus follicularis and Darlingtonia californica. Oecologia, 112:464-71
(15) Moran J.A. et al. (2003): From carnivore to detritivore? Isotopic evidence for leaf litter utilization by the tropical pitcher plant Nepenthes ampullaria. Int J Plant Sci, 164:635-9.


